Apakah itu Sel Kimia? Artikel ini akan membincangkan definisi sel kimia, jenis yang ada berserta kegunaan dan aplikasi dalam kehidupan seharian.
Definisi
Sel kimia ataupun sel voltek atau juga dikenali sebagai sel galvanik adalah sel elektrokimia yang menggunakan tindak balas kimia untuk menjana tenaga elektrik.
Di dalam tindak balas pengoksidaan dan penurunan, elektron dipindahkan daripada satu logam kepada logam yang lain. Tenaga dibebaskan jika tindak balas terjadi secara spontan.
Maka, tenaga yang dibebaskan tersebut digunakan untuk melakukan pelbagai proses. Untuk mengatasi tenaga tersebut, tindak balas tersebut perlulah dipisahkan kepada dua proses, iaitu pengoksidaan dan penurunan melalui sel kimia yang dijalankan di dalam dua bekas yang berbeza.
Prinsip sel kimia
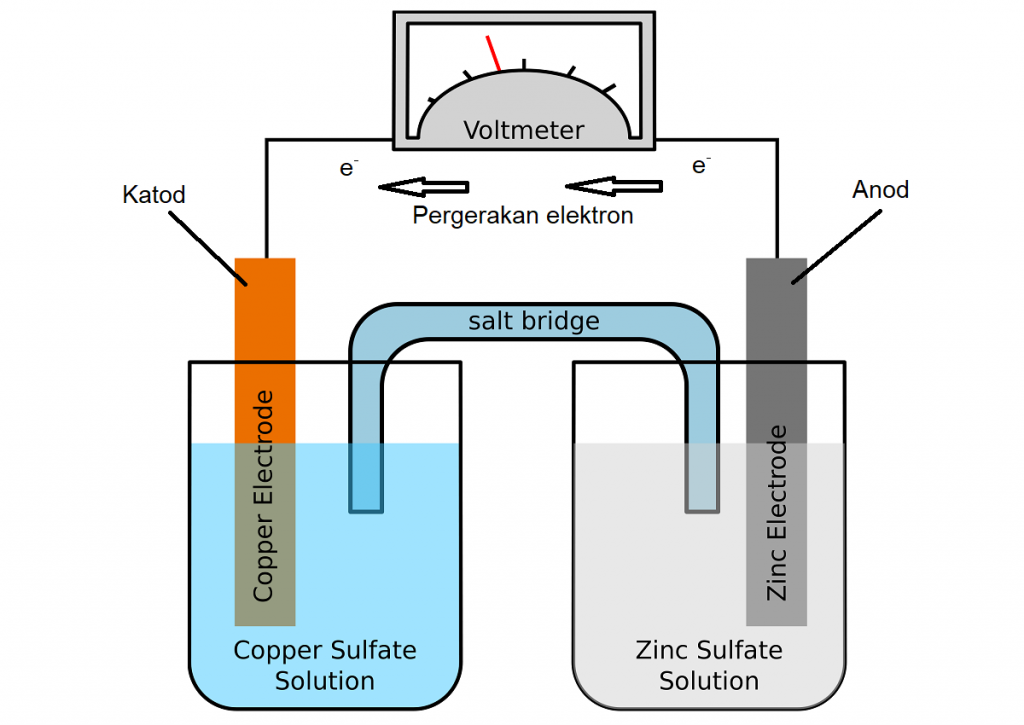
Penghasilan tenaga elektrik oleh sel kimia berpunca daripada tenaga Gibbs daripada tindak balas spontan redoks sel kimia. Secara amnya, ia mengandungi dua sel separuh yang terletak di dalam dua bekas yang berbeza. Kedua-dua sel ini dihubungkan oleh jambatan garam. Setiap sel separuh tersebut terdiri daripada elektrod logam yang dicelupkan ke dalam elektrolit. Kedua-dua sel separuh tersebut kemudiannya dihubungkan dengan voltmeter.
Dalam sesetengah keadaan, apabila kedua-dua elektrod tersebut dicelupkan ke dalam elektrolit yang sama, jambatan garam tidak lagi diperlukan.
Bahagian di dalam sel kimia
- Anod- proses pengoksidaan berlaku di elektrod tersebut
- Katod- proses penurunan berlaku di elektrod tersebut
- Jambatan garam- mengandungi elektrolit yang diperlukan untuk melengkapkan litar di dalam sel kimia
- Sel separuh- tindak balas penurunan dan pengoksidaan dipisahkan mengikut bahagian sel separuh
- Litar luar- mengalirkan elektron di antara elektrod
- Beban- sebahagian daripada litar yang membantu elektron untuk mengalir
Prinsip kerja sel kimia
Apabila elektrod dicelup ke dalam elektrolit dan kedua-duanya berada di dalam sel kimia, atom di dalam elektrod logam mempunyai kecenderungan untuk menjana ion di dalam larutan elektrolit.
Hal ini akan meninggalkan elektron di elektrod dan menjadikan elektrod logam bercas negatif. Sementara itu, dalam masa yang sama, ion logam yang berada di dalam larutan elektrolit juga mempunyai kecenderungan untuk terbentuk di atas elektrod logam menjadikan elektrod bercas positif.
Di dalam keadaan keseimbangan, pemisahan cas diperhatikan. Bergantung kepada kecenderungan dua tindak balas yang berlawanan, elektrod boleh menjadi elektrod yang bercas negatif atau positif.
Maka, perbezaan potensi boleh terjadi di antara kedua-dua elektrod dan elektrolit. Perbezaan potensi di antara dua elektrod ini dikenali sebagai potensi elektrod.
Daripada dua elektrod berkenaan, elektrod yang mana berlakunya proses pengoksidaan dipanggil sebagai anod manakala, tempat yang berlakunya proses penurunan pula dipanggil sebagai elektrod katod. Anod mempunyai potensi negatif, dan katod pula mempunyai potensi positif yang berkenaan dengan larutan.
Apabila arus dihasilkan daripada sel kimia, potensi sel dikenali sebagai daya elektromotif sel kimia. Apabila suis dihidupkan, perbezaan potensi akan menyebabkan elektron mengalir daripada elektrod negatif kepada elektrod positif lalu menghasilkan arus elektrik.
Contoh sel kimia
Sel kimia diperkenalkan sebagai salah satu alat untuk mengkaji sifat termodinamik sesuatu garam berabad yang lalu. Sel Daniel adalah salah satu contoh bagi sel kimia yang menukarkan tenaga kimia kepada tenaga elektrik. Di dalam sel Daniel, ion tembaga (Cu) diturunkan di katod sementara Zink dioksidakan di anod.
Tindak balas yang berlaku di anod dan katod di dalam sel Daniel boleh diperhatikan melalui persamaan berikut:
Di katod: Cu 2+ + 2e– → Cu
Di anod: Zn → Zn2+ + 2e–
Jenis sel kimia
Terdapat dua jenis sel kimia, antaranya ialah sel pertama dan sel kedua.
- Sel pertama: sel yang bertindak sebagai sumber kuasa elektrik tanpa perlu dicas dengan arus eletrik daripada sumber luas. Di dalam sel jenis ini, tenaga eletrik diperolehi semata-mata daripada kereaktifan kimia selagi terdapatnya bahan aktif di dalam sel. Antara contoh sel pertama adalah sel kering, sel merkuri dan sel alkali.
- Sel kedua: sel jenis ini boleh dicaskan semula dengan melalukan arus melaluinya. Ia boleh digunakan semula berkali-kali. Perubahan kimia berlaku apabila sel dicas menggunakan eletrik yang kemudiannya akan menukarkan semula elektrod kepada bentuk yang asal. Sel bateri kedua dikategorikan mengikut bahan yang digunakan untuk membinanya, antaranya adalah sel nikel-kadmium, sel plumbum-asid, dan sel litium-ion.
Kelebihan sel kimia
Antara kelebihan sel kimia adalah:
- Sel kedua menghasilkan jumlah eletrik yang besar dan stabil untuk tempoh jangka masa yang panjang.
- Sel kedua boleh dicas semula berkali-kali.
- Sel pertama lebih ringan dan mudah dibawa ke mana-mana.
- Sel pertama membekalkan arus eletrik dan voltan yang stabil.
Kekurangan sel kimia
Antara kekurangan yang ada pada sel kimia adalah;
- Sel kedua adalah mahal.
- Sel asid-plumbum adalah berat dan asid berisiko untuk tertumpah.
- Sel pertama tidak mempunyai jangka hayat yang lama.
- Sel pertama tidak boleh dicas semula.
Aplikasi sel kimia
Daripada sel kimia inilah kita boleh menghasilkan apa yang kita panggil sebagai bateri. Antara aplikasi sel kimia dalam kehidupan seharian kita adalah
- Sel kimia digunakan di dalam jam tangan, jam dinding, alat kawalan jauh, mesin kira-kira, dan pelbagai lagi.
- Ia juga turut digunakan di dalam sel telefon, kamera, komputer riba dan pelbagai lagi peranti yang boleh dicas berkali-kali.
- Sel kimia juga boleh digunakan di dalam sel bahan bakar untuk enjin.
- Ia turut digunakan di dalam mainan kanak-kanak sebagai sumber kuasa yang menggerakkan mainan.
Rujukan
- Akash Baiju (2021). Galvanic cell (Voltaic cell).
- Chakrasthita (2021). Voltaic Cell – Construction, Types, How it Works, Applications, Advantages. Electrical Funda Blog.