Apakah itu ikatan kimia? Artikel ini akan membincangkan berkenaan definisi ikatan kimia, jenis-jenisnya dan contoh di dalam kehidupan.
Definisi
Ikatan kimia adalah satu istilah yang merujuk kepada sambungan antara atom di dalam molekul. Ia merupakan perkara yang paling asas di dalam kimia yang bertanggungjawab menerangkan tentang konsep-konsep lain seperti pergerakan zarah, molekul, serta tindak balas dan pembentukan sesuatu sebatian kimia.
Tanpa ikatan kimia ini, para saintis tidak akan mampu untuk menerangkan tentang mengapa atom tertarik antara satu sama lain atau bagaimana sesuatu produk terbentuk di akhir tindak balas.
Atom lebih cenderung untuk mengatur diri sendiri di dalam corak yang paling stabil yang mungkin, yang bermaksud ia mempunyai kecenderungan untuk melengkapkan atau mengisi orbit elektron yang terluar dengan cara bergabung dengan atom yang lain. Daya tarikan yang memegang atom supaya kekal bersama membentuk satu molekul itulah yang dinamakan sebagai ikatan kimia.
Antara contoh-contoh ikatan kimia adalah;
- Ikatan kovalen
- Ikatan ion
- Ikatan logam
- Ikatan hidrogen
- Ikatan datif
1. Ikatan kovalen.
Ikatan kovalen terjadi apabila dua atau lebih atom berkongsi elektron antara satu sama lain. Ikatan ini kebanyakkannya terjadi di antara atom dari jenis yang sama (pembentukan H2, Cl2, O2 dan lain-lain) atau di antara dua atom dari jenis yang berbeza (pembentukan H2O, CH4, NH3).
Unsur yang mempunyai tenaga pengionan yang sangat tinggi tidak mempunyai kemampuan untuk memindahkan elektron, manakala unsur yang mempunyai pertalian elektron (electron affinity) yang rendah tidak mampu untuk menerima elektron. Maka, atom-atom daripada unsur tersebut menggunakan ikatan kovalen dengan cara berkongsi elektron untuk mencapai konfigurasi oktet di dalam petala yang terluar dan seterusnya mencapai kestabilan.
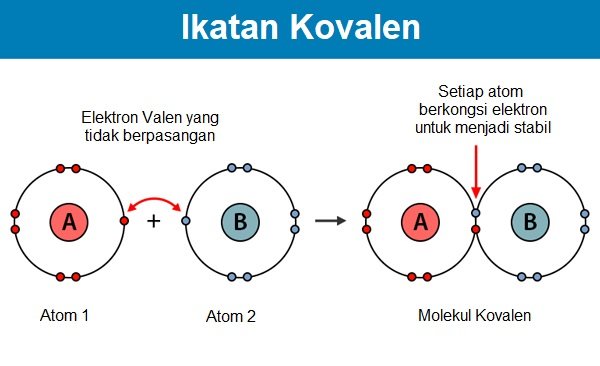
Ciri-ciri ikatan kovalen
- Ikatan kovalen tidak menghasilkan pembentukan elektron yang baharu. Ikatan tersebut hanya menggandingkan elektron.
- Ia adalah ikatan kimia yang sangat kuat yang wujud di antara atom.
- Ikatan kovalen jarang-jarang terputus secara spontan selepas ia terbentuk.
- Sebatian yang terbentuk dengan ikatan kovalen kebiasaannya mempunyai nilai entalpi pengewapan dan pelakuran yang rendah.
- Sebatian kovalen tidak larut di dalam air.
- Sebatian yang terbentuk oleh ikatan kovalen tidak boleh mengalirkan elektrik kerana sebatian tersebut mengandungi elektron bebas yang sedikit.
- Kebanyakan sebatian yang mempunyai ikatan kovalen menunjukkan takat didih dan takat lebur yang rendah.
2. Ikatan ion.
Ikatan ion terbentuk apabila elektron dipindahkan daripada satu atom daripada sesuatu unsur kepada unsur yang lain, yang menghasilkan ion yang bercas positif dan negatif. Ikatan yang terbentuk daripada pemindahan elektron inilah yang dipanggil sebagai ikatan ion.
Ikatan ini hanya terjadi di antara unsur logam dan bukan logam. Ia tidak akan terbentuk sekiranya unsur yang terlibat terdiri daripada dua unsur bukan logam. Dengan kata lainnya, ikatan ion ini melibatkan pemindahan elektron kepada atom yang berbeza supaya kedua-duanya mencapai konfigurasi oktet.
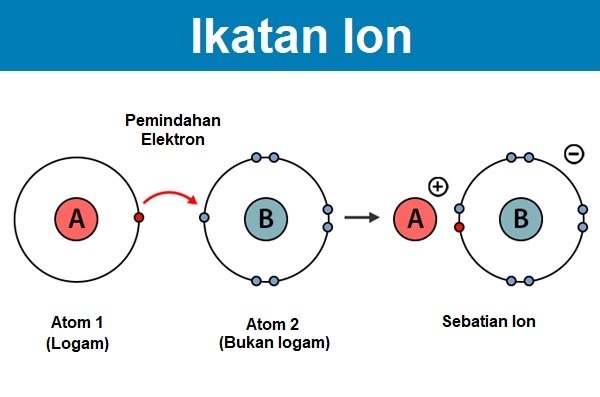
Ciri-ciri ikatan ion.
- Ikatan ion adalah ikatan yang terkuat di antara banyak-banyak ikatan kimia yang lain.
- Ikatan ion mempunyai pemisahan cas, makai a merupakan ikatan yang paling reaktif
- Ia mempunyai takat didih dan lebur yang tinggi.
- Molekul yang terbentuk disebabkan oleh ikatan kimia adalah pengalir elektrik yang baik.
3. Ikatan Hidrogen
Apabila atom hidrogen berhubung dengan atom yang mempunyai keelektronegatifan yang tinggi di dalam sesuatu molekul, ia akan lebih menarik pasangan elektron, maka di bahagian hujung molekul tersebut akan bercas sedikit negatif manakala di hujung bahagian hujung yang satu lagi akan bercas sedikit positif. Bahagian hujung molekul yang bercas negatif tersebut akan menarik bahagian positif molekul yang lain dan hasilnya adalah, ikatan yang lemah di antara dua molekul tersebut akan terbentuk. Ikatan itulah yang dipanggil sebagai ikatan hidrogen.
Ikatan hidrogen menghubungkan dua atom yang berelektronegatifan secara serentak, satu dengan menggunakan ikatan kovalen manakala satu lagi menggunakan ikatan hidrogen.
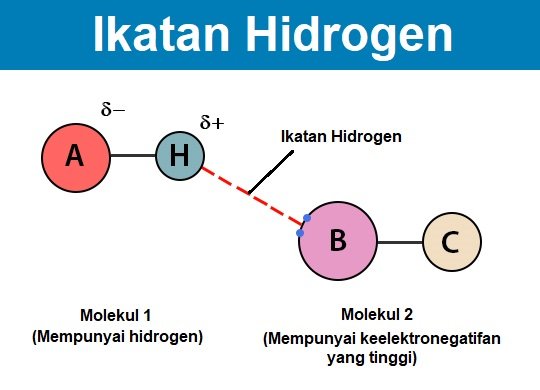
Syarat-syarat pembentukan ikatan hidrogen
- Molekul mestilah mengandungi atom yang berelektronegatifan tinggi yang berhubung dengan atom hidrogen.
- Saiz atom berelektronegatifan harus kecil. Lebih kecil saiz, lebih besar daya tarikan elektrostatik yang terhasil.
4. Ikatan logam
Ikatan logam adalam terma yang digunakan untuk memerihalkan perkongsian bersama lautan elektron yang berada di petala terluar di antara beberapa ion logam yang bercas positif. Ikatan logam adalah sejenis ikatan kimia yang bertanggungjawab untuk beberapa ciri yang ada pada logam, antaranya adalah permukaan yang berkilau, kelenturan logam, dan kebolehan mengalirkan haba dan eletrik.
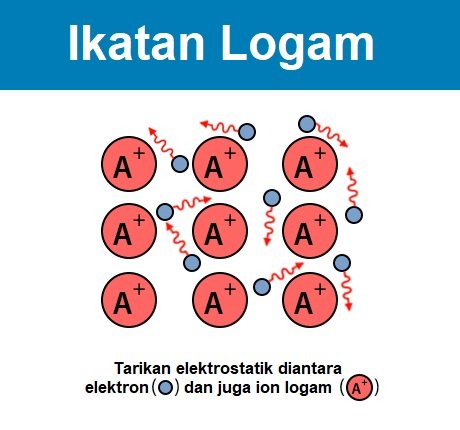
Faktor yang memperngaruhi ikatan logam
- Jumlah keseluruhan elektron yang dibebaskan
- Magnitud cas positif yang dipegang oleh ion positif logam
- Jejari ion bercas positif
5. Ikatan datif
Ikatan datif adalah sejenis ikatan alternatif bagi ikatan kovalen yang terbentuk daripada perkongsian pasangan elektron daripada satu atom. Kedua-dua elektron yang dikongsi itu akan didermakan oleh atom yang sama. Kebiasaannya, ikatan ini terbentuk daripada tindak balas yang melibatkan dua unsur bukan logam seperti atom hidrogen atau ikatan ini terbentuk di antara ion logam dan ligan (ligand).
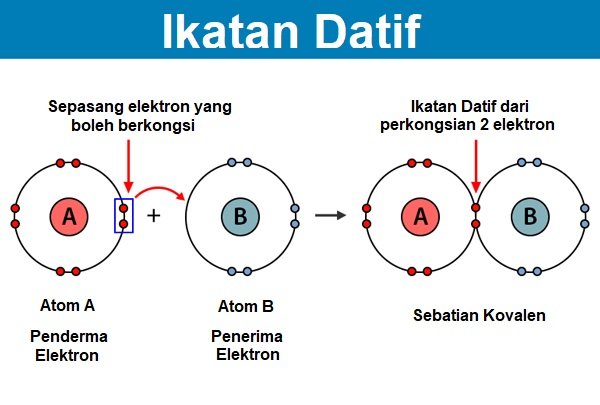
Ciri-ciri ikatan datif
- Di dalam ikatan ini, atom yang berkongsi pasangan elektron dari dirinya sendiri dikenali sebagai penderma elektron.
- Atom yang lain yang menerima pasangan elektron dikenali sebagai penerima.
- Selepas proses perkongsian elektron, setiap atom akan mencapai kestabilan.
- Jenis ikatan ini adalah berpandukan teori Lewis.
Rujukan:
- Akash Byjus (2021). Covalent Bond.
- Covalent Bonds. (2020). Libretext
- Akash Byjus (2021). Ionic Bond.
- Akash Byjus (2021). Hydrogen Bonding.
- Akash Byjus (2021). Metallic Bond.
- Lumen (2021). Coordinate Covalent Bond.
- Akash Byjus (2021). Co-Ordinate Bond.